Reacciones en química orgánica
Las reacciones orgánicas son reacciones químicas que involucran al menos un compuesto orgánico como reactivo. Los tipos básicos de reacciones químicas orgánicas son reacciones de adición, reacciones de eliminación, reacciones de sustitución, y reacciones redox orgánicas. En síntesis orgánica, se usan reacciones orgánicas en la construcción de nuevas moléculas orgánicas. La producción de muchos químicos hechos por el hombre, tales como drogas, plásticos, aditivos alimentarios, textiles, dependen de las reacciones orgánicas.

REACTIVIDAD DE LOS COMPUESTOS ORGÁNICOS
-Se debe a los grupos funcionales.
- Por alta densidad electrónica (doble o triple enlace) -
- Por fracción de carga positiva en el átomo de carbono (enlaces C-Cl, C=O, C=N)
- Homolítica (por la presencia de radicales libres)
- Heterolítica (el par electrónica va a un átomo)
DESPLAZAMIENTOS ELECTRÓNICOS
- Efecto inductivo: “Desplazamiento parcial del par electrónico en enlace sencillo “O” hacia el átomo más electronegativo provocando fracciones de carga”.
- Efecto mesómero o resonancia: “Desplazamiento del par de electrones “pi” del doble enlace hacia uno de los átomos por la presencia de pares electrónicos cercanos”.
El hidrógeno se toma como referencia (no provoca efecto inductivo)
-I: Grupos que retiran electrones
Ejemplos: -NO2, -COOH, -X (halógeno), -OH...+I: Grupos que aportan electrones.
Ejemplos: -CH3, -CH2-CH3, -C(CH3), -COO-, -O-...
- Se transmite a lo largo de la cadena a enlaces adyacentes, aunque cada vez más débilmente.
Se produce cuando hay enlace múltiples y la posibilidad de que los e – se deslocalicen (átomo electronegativo con posibilidad de tener parejas de e – sin compartir).
- Todos los enlaces son intermedios entre simples y dobles.
- A mayor número de formas resonantes mayor estabilidad.
CLASES DE EFECTOS MESÓMEROS
+M: Se produce por la cesión de un par de e– sin compartir del átomo unido al carbono formándose un doble enlace.
-M: El átomo unido al carbono coge para sí un par de electrones del doble o triple enlace.
-Suele producirse en presencia de luz UV pues necesita un aporte de energía elevado.- HETEROLÍTICA: El enlace se rompe de manera asimétrica (uno de los átomos se queda con los dos electrones que compartían).
A : B >>>>> A:- + B-
RADICALES LIBRES
Terciario > Secundario > Primario > Metilo
CARBOCATIONES
Grupos +I lo estabilizan
Grupos -I lo estabilizan
- Son muy inestables y sólo son posibles si el átomo de “C” lleva unido grupos “–I” que le liberen de parte de esa carga negativa.
Ejemplo: Indica la ruptura heterolítica más probable del a) bromoetano; b) 2-propanol; c) 2-cloro-2-metil-propano.
-HOMOLÍTICOS
Radicales libres
-Son especies químicas que tienen átomos con electrones desapareados.
-Se forman en la reacciones con ruptura homolítica.
-NUCLEÓFILOS
Tienen uno o más pares de electrones libres (bases de Lewis).
-Atancan a partes de molécula con deficiencias de electrones.
-ELECTRÓFILOS
Tienen orbitales externos vacíos (ácido le lewis)
-Atacan a zona con alta densidad electrónica (dobles o triples enlaces)
EJEMPLOS DE REACTIVOS NUCLEÓFILOS Y ELECTRÓFILOS
Ejercicio: Clasifica según sean nucleófilos o electrófilos los siguientes reactivos: R–NH2 ; I+ ; BH3 ; R–OH; R–CN; Br– ; CH3–CH2–O– ; CH3–COO– ; Ca2+ .
REACCIONES QUÍMICAS PRINCIPALES
Sustitución
-Un grupo entra y otro sale
-A un doble o triple enlacesDe un grupo de átomos
- Se produce un doble enlace
(Cambia el E.O. del carbono)
REACCIONES DE SUSTITUCIÓN
Radicálica
Se produce en tres frases
-Iniciación
-Propagación
-Terminación
Electrófila
Un reactivo electrófilo ataca zonas de alta densidad electrónica (Dobles enlaces del anillo bencénico)
Nucleófila
Un reactivo nucleófilo ataca a un carbocatión.
SUSTITUCIÓN HOMOLÍTICA (EJEMPLO)
Se da, por ejemplo, en la halogenación de alcanos (con luz U.V. o en presencia de peróxidos).
Iniciación
Propagación
Terminación
REACCIONES DE SUSTITUACIÓN ELECTRÓFILA
EJEMPLO DE NITRACIÓN (-M)
MECANISMO DE SUSTITUCIÓN ELECTRÓFILA (HALOGENACIÓN)(+M)
SUSTITUCIÓN ELECTRÓFILA
EJEMPLO DE ALQUILACIÓN (+I) (Friedelf-Crafts)
- Se produce cuando un reactivo nucleófilo ataca a un carbocatión.
- Para ello, es necesario que el carbono que va ha sufrir el ataque esté unido a un elemento muy electronegativo para que quede con déficit electrónico.
- Vamos a estudiar dos casos de sustitución nucleófila:
-Sustitución en alcoholes.
- NOTA: Esta reacción compite con la de eliminación, si bien en este caso, por formarse un carbocatión estable (terciario) se favorece la sustitución.
- Sustitución de alcoholes
MECANISMOS DE SUSTITUCIÓN NUCLEÓFILA
- Sustitución unimolecular (SN1)
- Sustitución bimolecular (SN2)
- Electrófila (a doble o triple enlace)
-Siguen la regla de Markownikooff
“La parte positiva del reactivo se adiciona al carbono más hidrogenado”
- Nucleófila En sustancia orgánicas con dobles enlaces fuertemente polarizados.
- Radicálica Es poco frecuente.
EJEMPLOS DE REACCIONES DE ADICIÓN
– (La carga positiva la soporta mejor el carbono secundario que el primario por estar mejor compensada por el efecto +I de dos grupos CH3 y C–H2 (regla de Markownikoff).
REACCIONES DE ELIMACIÓN
De la molécula orgánica se elimina una pequeña molécula; así, se obtiene otro compuesto de menor masa molecular.
Siguen la regla de Saytzeff:
“En las reacciones de eliminación el hidrógeno sale del carbono adyacente al grupo funcional que tiene menos hidrógenos”
EJEMPLOS DE REACCIONES DE ELIMINACIÓN
Vamos a estudiar dos casos:
-NOTA: Esta reacción compite con la de sustitución, si bien en este caso, por formarse un carbocatión menos estable (secundario) se favorece la eliminación.
REACCIONES REDOX
- En orgánica existen también reacciones redox.
- Es más complejo determinar el estado de oxidación del C, ya que en una misma cadena, cada átomo de C puede tener un estado de oxidación distinto.
- Como consecuencia de ello, al calcular el estado de oxidación, en ocasiones salen números fraccionarios, que no son sino las medias aritméticas de los estados de oxidación de cada uno de los átomos de carbono.
- Habitualmente, se sigue utilizando el concepto de oxidación como aumento en la proporción de oxígeno y reducción como disminución es la proporción de oxígeno.
- Los alquenos se oxidan con formando dialcoholes:

- Si no se toman precauciones la oxidación puede ser más profunda y formarse aldehídos y/o cetonas.
- Es una reacción específica del doble enlace, que consiste en la ruptura del mismo partiendo la cadena en dos y formando ácidos carboxílicos o cetonas:
- En presencia de un ambiente reductor, es posible obtener aldehídos en vez de ácidos carboxílicos.
OXIDACIÓN DE ALCOHOLES
- Los alcoholes se oxidan por acción del KMnO4 o del K2Cr2O7 a aldehídos o cetonas dependiendo de si se trata de un alcohol primario o secundario, respectivamente.
- Los alcoholes terciarios, en cambio, son bastante resistentes a la oxidación.
OXIDACIÓN Y REDUCCIÓN DE ALDEHÍDOS Y CETONAS
- Los aldehídos son sustancias muy frágiles y reductoras y se oxidan con facilidad a ácidos.
- Los aldehídos también pueden transformarse en alcoholes primarios e incluso en hidrocarburos en presencia de un ambiente reductor fuerte, dependiendo del catalizador empleado.
- En cambio, las cetonas sufren reacciones de reducción similares a los aldehídos, pero se resisten a ser oxidadas.
EJEMPLOS
- Constituyen un caso especial dentro de las reacciones redox. En ellas, el compuesto se quema para formar CO2 y H2O y liberándose gran cantidad de energía.
OTRAS REACCIONES ORGÁNICAS
- Esterificación/Hidrólisis ácida
- Saponificación (hidrólisis básica)
- Condensación
ESTERIFICACIÓN O HIDROLISIS ÁCIDOS
- Se produce entre ácidos carboxílicos cuando reaccionan con alcoholes:
R–COOH + R’–OH R–CO–O–R’ + H2O
- Se forman ésteres y se desprende una molécula de agua.
- Se trata de una reacción reversible.
OTRAS REACCIONES
Saponificación (hidrólisis básica):
– Es una reacción de las grasas (triésteres de la glicerina o propanotriol).
–Es una reacción irreversible.
CH3–CHO + NH2–OH CH3–CH=N–OH + H2O
¡Ve el siguiente vídeo para conocer más sobre las reacciones orgánicas!
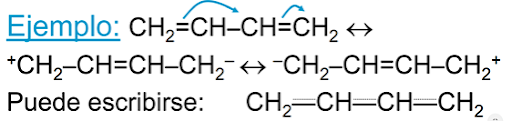



























Comentarios
Publicar un comentario