Introducción a los Alcanos
Los alcanos son compuestos formados exclusivamente por carbono e hidrógeno (hidrocarburos), que solo contienen enlaces simples carbono-carbono.
HIDROCARBUROS SATURADOS O ALCANOS
Sus principales características son:
- Fórmula general CnH2n+2
- Tienen enlaces covalentes sencillos
- Saturados: tienen todos los hidrógenos por carbono.
- Obtención: petróleo y el gas natural.
- Usos: Combustibles y sustrato para síntesis químicas.
- Hibridación sp3
- Los alcanos son hidrocarburos saturados, están formados exclusivamente por carbono e hidrógeno y únicamente hay enlaces sencillos en su estructura.
- Fórmula general: CnH2n+2 donde "n" represente el número de carbono del alcano.
- Esta fórmula nos permite calcular la fórmula molecular de un alcano. Por ejemplo para el alcano de 5 cabonos: C5H [(2*5)+2] = C5H12
- El estado físico de los 4 primeros alcanos: metano, etano, propano y butano es gaseoso.
- Del pentano al hexadecano (16 átomos de carbono) son líquidos y a partir de heptadecano (17 átomos de carbono) son sólidos.
- El punto de fusión, de ebullición y la densidad aumentan conforme aumenta el número de átomos de carbono.
- Son insolubles en agua.
- Pueden emplearse como disolventes para sustancias poco polares como grasas, aceites y ceras.
- El gas de uso doméstico es una mezcla de alcanos, principalmente propano.
- El gas de los encendedores es butano.
- El principal uso de los alcanos es como combustibles debido a la gran cantidad de calor que se libera en esta reacción.
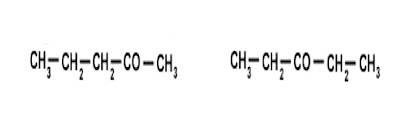
ISOMERÍA
Compuesto distintos con la misma fórmula molecular.
ISOMERÍA ESTRUCTURAL
ISOMERÍA DE FUNCIÓN
Cuando las dos moléculas presentan diferentes grupos funcionales
ISOMERÍA DE CADENA
Si varias sustancias isómeras tienen la misma función pero diferente cadena o esqueleto carbonado.
ISOMERÍA DE POSICIÓN
Cuando tienen la misma función e idéntica cadena carbonada, se van a diferenciar en la posición del grupo funcional.
Metámeros. Tienen el mismo grupo funcional sustituido de formas distintas.
ISOMERÍA CIS-TRANS
Distinta fórmula desarrollada
ISOMERÍA ÓPTICA
- Sólo se observa distinta distribución espacial (En tres dimensiones) de los carbonos grupos unidos a un átomo de carbono.
- Para que haya isómeros ópticos es necesario que los cuatro sustituyentes unidos a un átomo de carbono sean ¨Distintos¨ (carbono asimétrico).
ISOMERÍA ÓPTICA (cont).
- Se asigna un orden de prioridad a los grupos (por número atómico). Si dos de ellos fueran el mismo átomo el orden se determina por la prioridad de sus sustituyentes.
- Se sitúa el sustituyente 4 hacia atrás y se observa el triángulo que forman los otros tres. Si el orden 1-2-3 sigue las agujas del reloj el isómero se denomina R y si sigue el contrario se denomina S.
Nomenclatura de hidrocarburos
ALCANOS NO RAMIFICADOS O LINEALES
Los alcanos lineales se nombran mediante prefijos que indican el número de carbonos de la cadena (met, et, prop, but, pent, hex, hept, oct, non, dec, undec), seguido del sufijo -ano.
En ocasiones se antepone el prefijo n- para indicar que se trata de la configuración lineal.
¡Ve el siguiente vídeo para conocer más la nomenclatura de alcanos no ramificados!
REGLAS DE NOMENCLATURA
1. Elección de la cadena principal
1.1 Se elige la cadena de mayor numero de átomos de carbono.
1.2 Aquella de mayo numero de cadenas laterales.
1.3 Aquella de cadenas laterales con localizadores o posiciones más bajas.
1.4 Aquella de más carbonos en la cadena lateral mas pequeña
2. La numeración
2.1 Números mas bajos a los sustituyentes
2.2 Números mas bajos a los sustituyentes por orden alfabético.
3. El nombre
Localizadores - Sustituyentes + Nombre alcano
(Cadenas laterales) (Cadena principal)
3.1 Se anteponen los nombres de los sustituyentes por orden alfabético acompañados de su localizador o posición.
3.2 Sustituyentes repetidos en el mismo y/u otro carbono repiten el número y utilizan prefijos multiplicativos (di-, tri-, tetra, etc)
3.3. Los prefijos multiplicativos (di-, tri-, tetra, etc) no se alfabetizan
3.4. Los prefijos n-, sec-, terc- no se alfabetizan.
3.5. Los prefijos iso, neo y ciclo si se alfabetizan y se escriben sin guión.
3.6. Para nombrar a los radicales ramificados se aplican las mismas reglas.
- El C1 es el unido a la cadena principal.
- Los localizadores se escriben con primas o junto con el nombre del sustituyente entre paréntesis.
- Se alfabetiza el prefijo multiplicador del radical sencillo.
- Cuando hay varios radicales complejos se utiliza: bis, tris, tetrakis, etc, sin alfabetizar.
HIDROCARBUROS ALIFÁTICOS CÍCLICOS
1.1. Se antepone el prefijo ciclo- al nombre del alcano de igual número de carbonos.
1.2. Los radicales se nombran cambiando -ano por -ilo.
1.3. cicloalcanos sustituidos: se utilizan las mismas reglas que para alcanos. Cuando solo hay un sustituyente, no se precisa localizador.
1.5. Algunos ejemplos de cicloalcanos unidos por enlace C-C.
PROPIEDADES FÍSICAS
•Presentan serie homóloga: difieren en una unidad constante.
•A temperatura ambiente y a una atmósfera, los cuatro primeros son gases, del C5 al C16 son líquidos, del C17 y más son sólidos.
•Los puntos de ebullición aumentan al aumentar la cadena.
•Los puntos de fusión aumentan levemente (par o impar).
•Son menos densos de todos los grupos de moléculas orgánicas.
•Insolubles en agua, se disuelven en solvente de baja polaridad.
PROPIEDADES QUÍMICAS
• Falta de reactividad.
• No son atacados por ácidos o por agentes oxidantes enérgicos, o agentes reductores.
• Son atacados por el oxígeno a elevadas temperaturas.
• Se descomponen por temperaturas altas en ausencia de oxígeno.
• Sufren reacciones de halogenación.
• PIROLISIS: Se efectúa la escisión de alcanos de peso molecular grande en moléculas de menor tamaño.
PUNTOS DE EBULLICIÓN DE LOS ALCANOS RAMIFICADOS Y LINEALES
Se comparan los puntos de ebullición de los alcanos lineales (azul) con los de los alcanos ramificados (verde). Como tienen áreas superficiales más pequeñas, los alcanos ramificados tienen puntos de ebullición más bajos que los alcanos lineales.
PUNTOS DE FUSION DE LOS ALCANOS
La curva de los puntos de fusión de los n-alcanos de número par de átomos de carbono es ligeramente superior a la curva para los alcanos con número impar de carbonos.
ESTEREOQUIMICA DE LOS ALACANOS
EQUILIBRIO CONFORMACIONAL
Se puede transformar un confórmero en otro mediante la rotación en torno a enlaces simples, lo que no es posible en los esteroisómeros donde es necesario romper enlaces para transformar uno en otro.
Etano
EL ETANO
➔Al girar un grupo metilo alrededor del eje C-C, empezando a partir de la conformación alternada, la distancia entre los hidrógenos disminuye, dando lugar a un aumento en la repulsión entre los pares enlazantes de los enlaces C-H.
➔En el punto de eclipse, la molécula tiene su contenido máximo de energía.
➔El cambio de energía asociado a la rotación alrededor del un enlace se llama energía rotacional o torsional.
➔En este caso la superficie de energía potencial (SEP) es una función sinusoidal de periodo 120º y de amplitud 2.9 kcal/mol.
El propano
➔Es un sistema parecido al etano solo que se sustituye un hidrógeno por un metilo.
➔En este caso también las formas extremas son las alternadas y la eclipsadas.
➔La barrera en este caso es mayor que en el etano debido al impedimento estérico que en este caso involucra un metilo y un hidrógeno.
➔La variación es sinusoidal porque tenemos el mismo efecto en cada giro.
Tensión de anillo de un ciclobutano.
La tensión de anillo de un ciclobutano plano se debe a dos factores: la tensión angular debida a la compresión de los ángulos de enlace desde el ángulo tetraédrico de 109,5º hasta 90º, y la tensión torsional debida al eclipsamiento de los enlaces C-H.
La compresión para el butano es 19,5º. La tensión angular y la tensión torsional explican la alta reactividad de los anillos de cuatro átomos de carbono.
Conformaciones del ciclopropano.
Todos los enlaces carbono-carbono están eclipsados, generando una tensión torsional que contribuye a la tensión total del anillo. La tensión angular y la tensión torsional en el ciclopropano hacen que el tamaño de este anillo sea extremadamente reactivo.
CONFORMACIONES DEL CICLOPENTANO
La conformación del ciclopentano está ligeramente doblada, como la forma de un sobre. Esta conformación plegada reduce el eclipsamiento de los grupos CH2 adyacentes.
CONFORMACIÓN DE BOTE DEL CICLOHEXANO
La conformación de barca simétrica del ciclohexano, el eclipsamiento de los enlaces da lugar a tensión torsional. En la molécula representada, la barca se retuerce y se forma la barca torcida, una conformación con los enlaces menos eclipsados y con menor interacción entre los dos hidrógenos mástil.
➔El análisis conformacional del ciclohexano indica que las barreras del potencial son mayores y por lo tanto les podemos medir fácilmente en comparación con las otras familias.
➔El confórmero silla es el más estable.
➔Las otras conformaciones bote y twist (bote retorcido) son menos estables.













Comentarios
Publicar un comentario