Grupo carbonilo
Es el grupo químico que se representa cuando un carbono tiene un
doble enlace con un oxigeno. La palabra carbonilo puede referirse también al monóxido de carbono como ligando en un complejo inorgánico u organometálico (e.g. níquel carbonilo); en este caso, el carbono tiene un doble enlace con el oxígeno.
ALDEHÍDOS Y CETONAS
Compuestos orgánicos que contienen un doble enlace C=O
(denominado grupo carbonilo)
Nomenclatura IUPAC:
o Aldehídos: El nombre de la cadena seguida del sufijo -al (R-al)
o Cetonas: A la cadena completa se le añade el sufijo –ona (“R+C+R’-
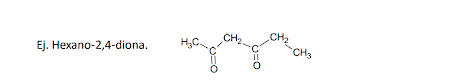
ona”). Hay que indicar la posición del carbono donde está el grupo.
o Aldehídos: La raíz del nombre de la cadena seguida de “aldehido”
o Cetonas: las dos cadenas (como radicales) seguido de “cetona”
RESUMEN
Los aldehídos se nombran reemplazando la terminación -ano del alcano correspondiente por -al. No es necesario especificar la posición del grupo aldehído, puesto que ocupa el extremo de la cadena (localizador 1).Cuando la cadena contiene dos funciones aldehído se emplea el sufijo -dial.
ALDEHIDOS
- Este grupo está formado por una molécula CHO, en donde el oxígeno está unido mediante un doble enlace al carbono.
- Al nombre de la cadena se le agrega la terminación al.
CETONA
•Este grupo está formado por una átomo de
carbono unido por un doble enlace a un
átomo de oxígeno. Alrededor de esta
molécula hay dos cadenas hidrocarbonadas.
•Existen dos formas de nombrar las cetonas.
PRIMERA FORMA DE NOMBRAR CETONAS
•Al nombre de la cadena se le agrega la
terminación ona.
•Cuando sea necesario, se indica con un
número la ubicación del grupo.
SEGUNDA FORMA DE NOMBRAR CETONAS
• Se nombran por orden alfabético (como si
fuesen sustituyentes) las dos cadenas que
rodean al carbono que tiene un doble
enlace con el oxígeno, y al final se coloca
la palabra cetona.
- Se nombran utilizando el sufijo –ona, -diona, etc.
- Las monocetonas pueden nombrarse también utilizando la nomenclatura por grupo funcional. Los grupos R y R’ se consideran sustituyentes del carbonilo y por tanto se citan como prefijos en orden alfabético. Para terminar el nombre se añade la palabra cetona. Ej. Bencil etil cetona.
- Cuando cetonas o aldehidos no son el grupo principal se nombran con el prefijo “- oxo”
CURIOSIDADES
Los aldehídos unidos directamente a un sistema cíclico se nombran añadiendo el
sufijo –carbaldehído al nombre del ciclo. Ej: ciclohexanocarbaldehído.
Si existen más de dos grupos carbonilo (fuera de la cadena), la cadena principal es
la más larga que contenga el mayor número de grupos CHO. El nombre se
construye añadiendo los sufijos –tricarbaldehído, etc. al nombre raiz que
corresponde a la cadena principal (descontando los carbonos de los grupos
carbonilo).
EJEMPLOS ALDEHIDOS Y CETONAS
- El grupo -CHO unido a un ciclo se llama -carbaldehído. La numeración del ciclo se realiza dando localizador 1 al carbono del ciclo que contiene el grupo aldehído.
- Algunos nombres comunes de aldehídos aceptados por la IUPAC son:
- Las cetonas se nombran sustituyendo la terminación -ano del alcano con igual longitud de cadena por -ona. Se toma como cadena principal la de mayor longitud que contiene el grupo carbonilo y se numera para que éste tome el localizador más bajo.
Propiedades físicas
- La presencia del grupo carbonilo convierte a los aldehídos y cetonas en compuestos polares.
Punto de ebullición
- Los puntos de ebullición de los aldehídos y cetonas son mayores que el de los alcanos del mismo peso molecular, pero menores que el de los alcoholes y ácidos carboxílicos comparables.
- (Esto se debe a la formación de dipolos y a la ausencia de formación de puentes de hidrógeno intramoleculares en éstos compuestos).
ALDEHIDOS
El metanal (aldehído fórmico) es el aldehído con mayor uso en la
industria, se utiliza fundamentalmente para la obtención de
resinas fenólicas y en la elaboración de explosivos (pentaeritrol
y el tetranitrato de pentaeritrol, TNPE) así como en la
elaboración de resinas alquídicas y poliuretano expandido.
También se utiliza en la elaboración de uno de los llamados plásticos técnicos que se utilizan fundamentalmente en la sustitución de piezas metálicas en automóviles y maquinaria, así como para cubiertas resistentes a los choques en la manufactura de aparatos eléctricos. Estos plásticos reciben el nombre de POM (polioximetileno).
También se utiliza en la elaboración de uno de los llamados plásticos técnicos que se utilizan fundamentalmente en la sustitución de piezas metálicas en automóviles y maquinaria, así como para cubiertas resistentes a los choques en la manufactura de aparatos eléctricos. Estos plásticos reciben el nombre de POM (polioximetileno).
CETONAS
La cetona que mayor aplicación industrial tiene es la acetona
(propanona) la cual se utiliza como disolvente para lacas y
resinas, aunque su mayor consumo es en la producción de
polímeros (plexiglás, resinas epoxi y poliuretanos).
Otras cetonas industriales son la metil etil cetona (MEK, siglas el
inglés) y la ciclohexanona que además de utilizarse como
disolvente se utiliza en gran medida para la obtención de la
caprolactama, que es un monómero en la fabricación del Nylon
6 y también por oxidación del ácido adípico que se emplea para
fabricar el Nylon 66.
ALDEHIDOS Y CETONAS
Muchos aldehídos y cetonas forman parte de los aromas naturales de flores y
frutas, por lo cual se emplean en la perfumería para la elaboración de aromas
como es el caso del benzaldehído (olor de almendras amargas), el aldehído
anísico (esencia de anís), la vainillina, el piperonal (esencia de sasafrás), el
aldehído cinámico (esencia de canela).
De origen animal existe la muscona y la civetona que son utilizados como fijadores
porque evitan la evaporación de los aromas además de potenciarlos por lo cual
se utilizan en la industria de la perfumería.
¡Ve el siguiente vídeo para conocer más sobre la nomenclatura de aldehídos y cetonas!
ÁCIDO CARBOXILICO Y ÉSTERES
Los ácidos carboxílicos constituyen un grupo de compuestos, caracterizados porque poseen un grupo funcional llamado grupo carboxilo o grupo carboxi (–COOH). En el grupo funcional carboxilo coinciden sobre el mismo carbono un grupo hidroxilo (-OH) y carbonilo (-C=O). Se puede representar como -COOH o -CO2H.
Ésteres. Son compuestos orgánicos en los cuales un grupo orgánico alquilo (simbolizado por R') reemplaza a un átomo de hidrógeno (o más de uno) de un ácido oxigenado. Un oxoácido es un ácido inorgánico cuyas moléculas poseen un grupo hidroxilo (OH-1) desde el cual el hidrógeno (H) puede disociarse como un ion hidrógeno, hidrón o comúnmente protón, (H+).
- Moléculas orgánicas que contienen un grupo hidroxilo (-OH) unido al carbono de un grupo carbonilo (-C=O).
- La combinación de estos grupos se denomina grupo carboxílico (-COOH).
Tienen carácter ácido porque en las reacciones ácido base se cede el átomo de H unido
al átomo de O.
Nomenclatura IUPAC: A la raíz de la cadena principal se le añade el sufijo “-oico” todo
precedido de la palabra ácido (ácido R-oico).
- Este grupo está formado por una molécula COOH, en donde uno de los oxígenos forma un doble enlace con el carbono.
- Al nombre de la cadena se antepone la palabra ácido y al final se agrega la terminación oico.
Ácidos carboxílicos (R-COOH)
Método sistematico: se nombran añadiendo los sufijos “–oico” ó “–dioico” al
nombre raiz. (R).
Ej: ácidos etanoico, CH3
- COOH
El carbono al que está enlazado el carboxilo lleva el índice 1 y el carbono
carbonílico no se numera en este sistema.
Si hay más de 2 grupos carboxílicos en la molécula se usa la notación:
“ácido 2,3,4 tricarboxilico” (los carbonos del COOH no se cuentan).
RESUMEN
La IUPAC nombra los ácidos carboxílicos cambiando la terminación -o de los alcanos por –
oico y anteponiendo la palabra ácido. La numeración de la cadena asigna el localizador 1
al ácido y busca la cadena de mayor longitud.
Grupo carboxílico unido a un ciclo
Los ácidos cíclicos se nombran terminando el
nombre del ciclo en -carboxílico precedido de la
palabra ácido.
Solubilidad: El grupo carboxilo –COOH confiere carácter polar a
los ácidos y permite la formación de puentes de hidrógeno
entre la molécula de ácido carboxílico y la molécula de agua.
Esto hace que los primeros cuatro ácidos monocarboxílicos
alifáticos sean líquidos completamente solubles en agua. La
solubilidad disminuye a medida que aumenta el número de
átomos de carbono.
- A partir del ácido dodecanóico o ácido láurico los ácidos carboxílicos son sólidos blandos insolubles en agua.
- Punto de ebullición: Los ácidos carboxílicos presentan puntos de ebullición elevados debido a la presencia de doble puente de hidrógeno.
- Punto de fusión: El punto de fusión varía según el número de carbonos, siendo más elevado el de los ácidos fórmico y acético, al compararlos con los ácidos propiónico, butírico y valérico de 3, 4 y 5 carbonos, respectivamente. Después de 6 carbonos el punto de fusión se eleva de manera irregular.
- Los ácidos carboxílicos son moléculas con geometría trigonal plana. Presentan hidrógeno ácido en el grupo hidroxilo y se comportan como bases sobre el oxígeno carbonílico.

- Los puntos de fusión y ebullición son elevados ya que forman dímeros, debido a los enlaces por puentes de hidrógeno

- La propiedad más característica de los ácidos carboxílicos es la acidez del hidrógeno situado sobre el grupo hidroxilo. El pKa de este hidrógeno oscila entre 4 y 5 dependiendo de la longitud de la cadena carbonada.

- Los sustituyentes atrayentes de electrones aumentan la acidez de los ácidos carboxílicos. Grupos de elevada electronegatividad retiran carga por efecto inductivo del grupo carboxílico, produciendo un descenso en el pKa del hidrógeno ácido.

- El efecto inductivo aumenta con la electronegatividad del halógeno, con la proximidad del halógeno al grupo carboxílico y con el número de halógenos.
En un éster, se remplaza un hidrógeno del grupo
carboxilo por un grupo alquilo o arilo.
- Se consideran derivados de los ácidos carboxílicos, en los que el H del grupo hidroxilo ha sido sustituido por una cadena hidrocarbonada (R’).
- Los ésteres reciben nombres como si fueran sales inorgánicas.
- Se nombran como el ácido carboxílico del que derivan, sustituyendo el sufijo “-oico” por “-ato” seguido de la preposición “de” +nombre del grupo R’ (tomado como sustituyente).

- Se nombran como alcanoatos de alquilo (metanoato de metilo).
Se termina el nombre del alcano en -ato de alquilo. Cuando va unido a un ciclo el grupo
éster se nombra como -carboxilato de alquilo.

Éster como sustituyente
Cuando en la molécula existe un ácido carboxílico, el éster pasa a ser un mero
sustituyente y se ordena por orden alfabético con el resto de sustituyentes de la
molécula denominándose alcoxicarbonil.

PROPIEDADES
- Los ésteres dan sabor y olor a muchas frutas y son los constituyentes mayoritarios de las ceras animales y vegetales.
- La hidrólisis de los ésteres está catalizada por ácidos o bases y conduce a ácidos carboxílicos.
- Los ésteres reaccionan con alcoholes con catálisis ácida o básica obteniéndose un nuevo éster sin necesidad de pasar por el ácido carboxílico libre. Esta reacción se denomina transesterificación.
¡Ve el siguiente vídeo para conocer más sobre la nomenclatura de ésteres!
TIOÉSTERES
- En un tioéster, se remplaza un oxígeno de un éster con un azufre.
- Los Tioésteres son compuestos que resultan de la unión de un sulfuro con un grupo acilo con la fórmula general R-S-CO-R'. Son un producto de la esterificación entre un ácido carboxílico y un tiol (en analogía a un grupo alcohol en los ésteres regulares).En bioquímica un tioéster conecta los grupos acetilo del acetil-CoA y malonil-CoA.

¡Ve el siguiente vídeo para conocer más sobre la nomenclatura de los Tioesteres!




































Revisado
ResponderEliminar