Alcohol
Los alcoholes pueden
considerarse los derivados
orgánicos del agua, donde uno
de los hidrógenos es sustituido
por un grupo orgánico: H-O-H
pasa a ser R-OH.

Es decir, aquellos hidrocarburos saturados, o alcanos que contienen un grupo hidroxilo (-OH) en sustitución de un átomo de hidrógeno enlazado de forma covalente. Si contienen varios grupos hidroxilos se denominan polialcoholes.
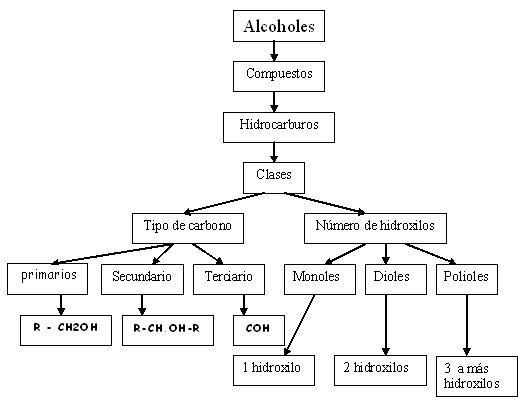
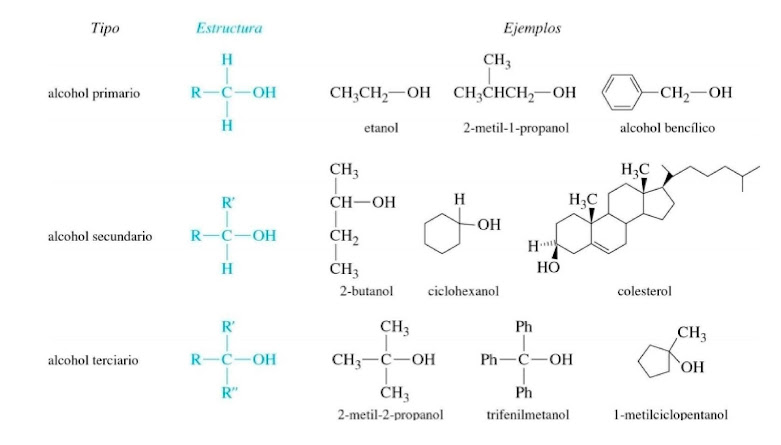
Estos pueden ser primarios, secundarios o terciarios, en función del número de átomos de hidrógeno sustituidos en el átomo de carbono al que se encuentran enlazado el grupo hidroxilo.
FUENTES NATURALES Y USOS DE LOS ALCOHOLES
- Durante la destilación del petróleo se recuperan ciertas cantidades de mezclas de alcoholes en el rango C3 hasta C5, que se utilizan principalmente como materias primas para la producción de otros compuestos.
- Cantidades importantes de glicerina, un alcohol con tres grupos hidroxilo, se obtienen en la saponificación de las grasas naturales para la producción de jabón. La glicerina se usa extensamente en la preparación de cremas y productos cosméticos.

- Durante la fermentación natural de soluciones dulces, (melazas o azúcares en agua, jugo de frutas dulces, etc.) se puede obtener una disolución de etanol hasta del 12% de concentración, que luego puede ser concentrada por destilación directa hasta el 95%. En condiciones especiales o con el uso de sales deshidratadoras puede incluso aumentarse la concentración hasta obtener etanol técnicamente puro.
- Los alcoholes primarios saturados de cadena recta en el rango C12 - C18, son muy importantes en la facturación de detergentes y se obtienen de la hidrogenación de las grasas naturales.
CLASIFICACIÓN
PROPIEDADES GENERALES
Los alcoholes son líquidos incoloros de baja masa molecular y de olor característico, solubles en el agua en proporción variable y menos densos que ella. Al aumentar la masa molecular, aumentan sus puntos de fusión y ebullición, pudiendo ser sólidos a temperatura ambiente (p.e. el pentaerititrol funde a 260 °C). También disminuye la solubilidad en agua al aumentar el tamaño de la molécula, aunque esto depende de otros factores como la forma de la cadena alquílica.
Algunos alcoholes (principalmente polihidroxílicos y con anillos aromáticos) tienen una densidad mayor que la del agua. Sus puntos de fusión y ebullición suelen estar muy separados, por lo que se emplean frecuentemente como componentes de mezclas anticongelantes. Por ejemplo, el 1,2-etanodiol tiene un punto de fusión de -16 °C y un punto de ebullición de 197 °C.
DATOS CURIOSOS DE SUS FUENTES
Muchos alcoholes pueden ser creados por fermentación de frutas o granos con levadura, pero solamente el etanol es producido comercialmente de esta manera, principalmente como combustible y como bebida. Otros alcoholes son generalmente producidos como derivados sintéticos del gas natural o del petróleo.

PROPIEDADES FISICAS DE ALCOHOLES
- El grupo –OH es polar y capaz de formar enlaces de hidrógeno.
- Esto permite que alcoholes de bajo peso molecular sean solubles en agua.
- Ejemplo: Enlaces de hidrógeno en una solución agua-metanol.
PROPIEDADES DE LOS ALCOHOLES
- Estado físico (a 25 ºC) • C1 a C4; son líquidos solubles totalmente en agua
- C5 a C12; líquidos aceitosos, no son tan solubles en agua.
- Los demás, son sólidos insolubles en agua.
- La insolubilidad disminuye con el aumento del peso molecular.
- Presentan entre sus moléculas enlace puente de hidrógeno, donde los polioles, poseen mayor número de enlaces puentes de hidrógenos
- Los polioles poseen mayor temperatura de ebullición que los monoles con igual número de carbonos.
- Son menos denso que el agua; los monoles que son inferiores, los polioles más densos.
Según el número de hidroxilo:
• Monoalcohol o monol: Cuando presenta
un hidroxilo
-CH3 - CH2 – OH
• Dialcohol, diol o glicol: Cuando presenta
dos hidroxilos
-CH2 – CH2
OH OH
• Trialcohol o triol: Cuando presenta tres
hidroxilo.
-CH2 – CH – CH2
OH OH OH
• Polialcohol poliol: Cuando presenta cuatro
o más hidroxilos.
¡Ve el siguiente vídeo para conocer más sobre los alcoholes!
DATOS Y ALCOHOLES IMPORTANTES
- Etanol (alcohol etílico, alcohol de grano): CH3CH2OH
- Producido comercialmente de etileno y a través de la fermentación biológica (levadura) de carbohidratos.
- Usado como solvente, combustible (gasohol), y se encuentra en las bebidas alcohólicas
- Moderadamente tóxico
TIPOS DE ALCOHOLES
NOMENCLATURA DE ALCOHOLES
Los alcoholes se pueden nombrar
de tres formas diferentes.
-Nomenclatura Oficial (IUPAC):
RAÍZ + OL
Ejemplos:
CH3 – OH
Metanol
CH3 – CH2 – OH
Etanol
CH3 – CH – CH2 – CH3 2-Butanol
OH
Otros grupos unidos a la cadena principal se indican también
por medio de números. Ejemplo:
CH3
I
CH3 – CH2 – C – CH3 2 METIL – 2 – BUTANOL
I
OH
Nomenclatura común:
Alcohol + nombre alquílico
Ejemplos:
CH3 – CH2 – OH Alcohol etílico
CH3 – OH Alcohol metílico
Alcoholes con dos o más grupos funcionales
Ejemplo:
CH3 – CH – CH2 1,2 – propanodiol
I I
OH OH
CH2 – CH2 – CH2 1,3 – propanodiol
I I
OH OH
REGLAS DE LA NOMENCLATURA DE ALCOHOLES
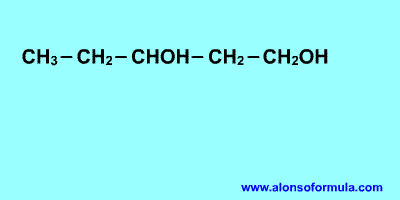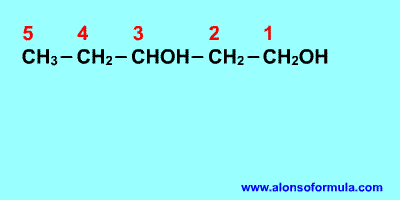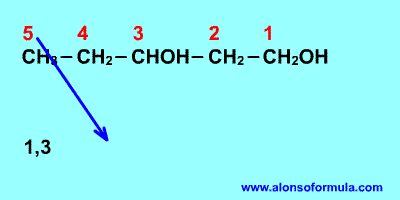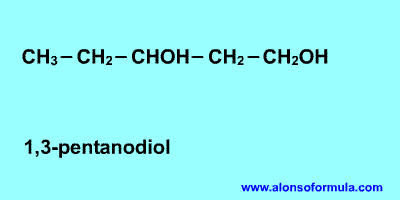
REGLA 1
Se elige como cadena principal la de mayor longitud
que contenga el grupo -OH.

Se numera la cadena principal para que el grupo -OH
tome el localizador más bajo. El grupo hidroxilo tiene
preferencia sobre cadenas carbonadas, halógenos, dobles y
triples enlaces.
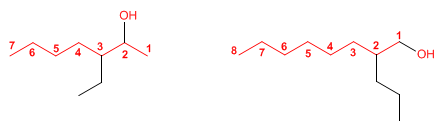
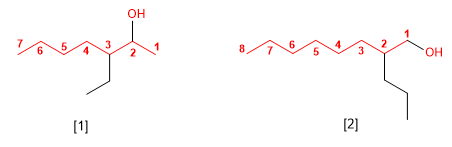
REGLA 3
El nombre del alcohol se construye cambiando la
terminación -o del alcano con igual número de carbonos por -ol.
REGLA 4
Cuando en la molécula hay grupos grupos
funcionales de mayor prioridad, el alcohol pasa a ser un
sustituyente y se llama hidroxi-.
Son prioritarios frente a los alcoholes: ácidos carboxílicos,
anhídridos, ésteres, haluros de alcanoilo, amidas, nitrilos,
aldehídos y cetonas.
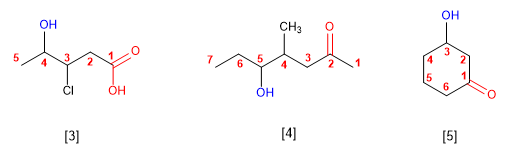
El grupo -OH es prioritario frente a los alquenos y
alquinos. La numeración otorga el localizador más bajo al -OH
y el nombre de la molécula termina en -ol.
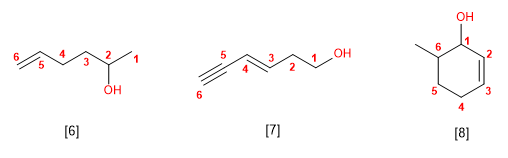
EJEMPLOS

Fenoles
Se pueden representar de dos formas distinta, una molécula de Fenol.
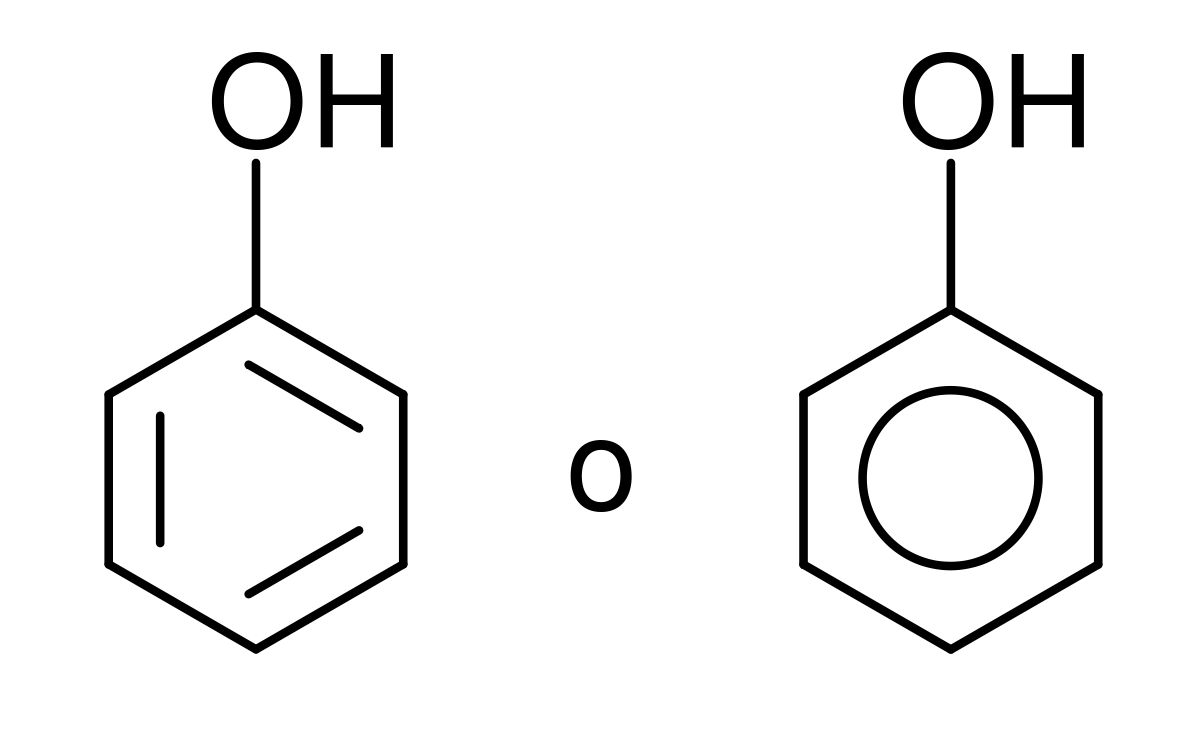
Los Fenoles son compuestos orgánicos que están formados por uno o varios Grupos Funcionales Hidroxilo (-OH) unidos a un anillo aromático (anillo de benceno).
Los Fenoles son un tipo de Alcoholes. Poseen las siguientes propiedades:
- Son ligenramente solubles en agua y mucho en éteres y alcoholes.
- Los Fenoles son ligeramente ácidos
- Son sólidos y poseen un aspecto cristalino
NOMENCLATURA COMUN
Con la nomenclatura común, no referimos a que son estructuras ya fijas.
PUNTOS DE FUSIÓN
- La mayoría de los fenoles son sólidos a temperatura ambiente, tan sólo unos cuántos son líquidos.
- Sus puntos de fusión son relativamente bajos.
- Los fenoles monosustituidos isoméricos, la forma para- es siempre la de mayor punto de fusión debido al hecho de ser la más simétrica.
PUNTOS DE EBULLICIÓN
- Los Fenoles hierven a temperatura bastante elevadas gracias a los puente de hidrógeno que su grupo funcional hidroxilo es capaz de formar.
SOLUBILIDAD
- Los fenoles son poco o moderadamente solubles en agua.
- Los isómeros o- pueden formar puentes de hidrógeno intramoleculares
- Si se introduce un segundo grupo OH se aumenta la solubilidad
Fenol 9.3
-cresol 2.5
m-cresol 2.6
p-cresol 2.3
o-clorofenol 2.8
m-clorofenol 2.6
p-clorofenol 2.8
Catecol 45
Resorcinol 123
Hidroquinona 8
CARACTERÍSTICAS GENERALES
- Son tóxicos si son ingeridos en altas dosis
- El fenol es utilizado como desinfectante al 5 % (se la llama agua fenificada)
- Son mucho más ácidos que los alcoholes porque el anillo aromático puede deslocalizar de manera efectiva la carga negativa del oxígeno dentro de los carbonos del anillo
- Son combustibles
Éteres
- Se caracterizan por poseer dos grupos carbonados ligados a un mismo átomo de oxígeno.
- Pueden ser:
• SIMÉTRICOS: Si los dos grupos
carbonados ligados al oxígeno
central son idénticos entre sí.
• ASIMÉTRICOS: Si ambos grupos son
distintos.
• CÍCLICOS
• AROMÁTICOS
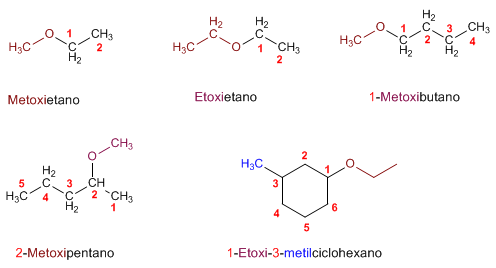
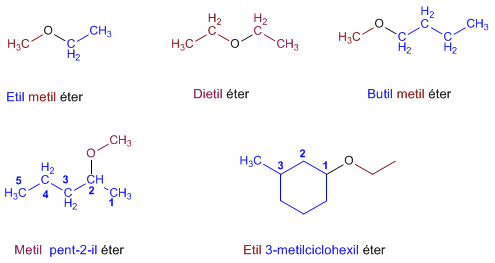
NOMENCLATURA DE ÉTERES
• Se nombran (en la nomenclatura común) por orden alfabético, los radicales unidos al
- O -, seguidos de la palabra ÉTER.
En la nomenclatura UIQPA, se nombra el radical más sencillo (con la palabra OXI),
seguido sin guión del nombre del hidrocarburo del que deriva el radical más
complejo.
EJEMPLOS
¡Ve el siguiente vídeo para conocer más sobre la nomenclatura de ÉTERES!
PROPIEDADES FÍSICAS
- Sustancias líquidas muy volátiles.
- Menos densos que el agua
- Los éteres son sustancias poco polares
- Como no poseen hidrógenos ácidos, no pueden formar puentes de hidrógeno.
- Los puntos de ebullición son similares a los alcanos de masa molecular correspondiente.
- Exhiben una solubilidad en agua muy parecida a la de los alcoholes.
- No pueden formar puentes de hidrógeno entre sí.
PROPIEDADES QUÍMICAS
- Son compuestos poco reactivos
- Se oxidan formando peróxidos (explosivos)
- Son altamente inflamables
- Disolventes
¡Ve el siguiente vídeo para conocer más!
Tioles
Los tioles, R-SH, son análogos azufrados de los alcoholes. Los tioles se
nombran por medio del sistema que se usa para los alcoholes, con el sufijo -
tiol en lugar de -ol. El grupo -SH mismo se conoce como grupo mercapto.

La propiedad más característica de un tiol es su olor, La raza humana es
muy sensible a estos compuestos pudiendo detectar su presencia a niveles
0,02 partes de tiol en mil millones de partes de aire. El olor de los zorrillos
se debe, principalmente, a algunos tioles sencillos.
Los tioles son también responsables de una clase de fallos en los vinos causados por la reacción no deseada entre el azufre y la levadura.
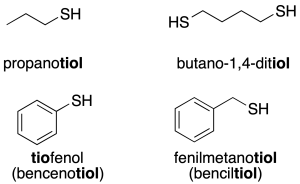
NOMENCLATURA DE TIOLES
Cuando un grupo tiol es un sustituyente de un alcano, hay varias formas de nombrar al tiol resultante:
- El método preferido (utilizado por la IUPAC) consiste en añadir el sufijo -tiol al nombre del alcano. El método es casi idéntico a la denominación de alcoholes. Ejemplo: CH3SH sería metanotiol.
- Otra manera de nombrar tioles, aunque se trata de un método viejo, consiste en substituir con la palabra mercaptano a la palabra alcohol en el nombre del compuesto alcohol equivalente. Ejemplo: CH3SH sería metil mercaptano.
- Como prefijo, el término utilizado es mercapto. Ejemplo: mercaptopurina
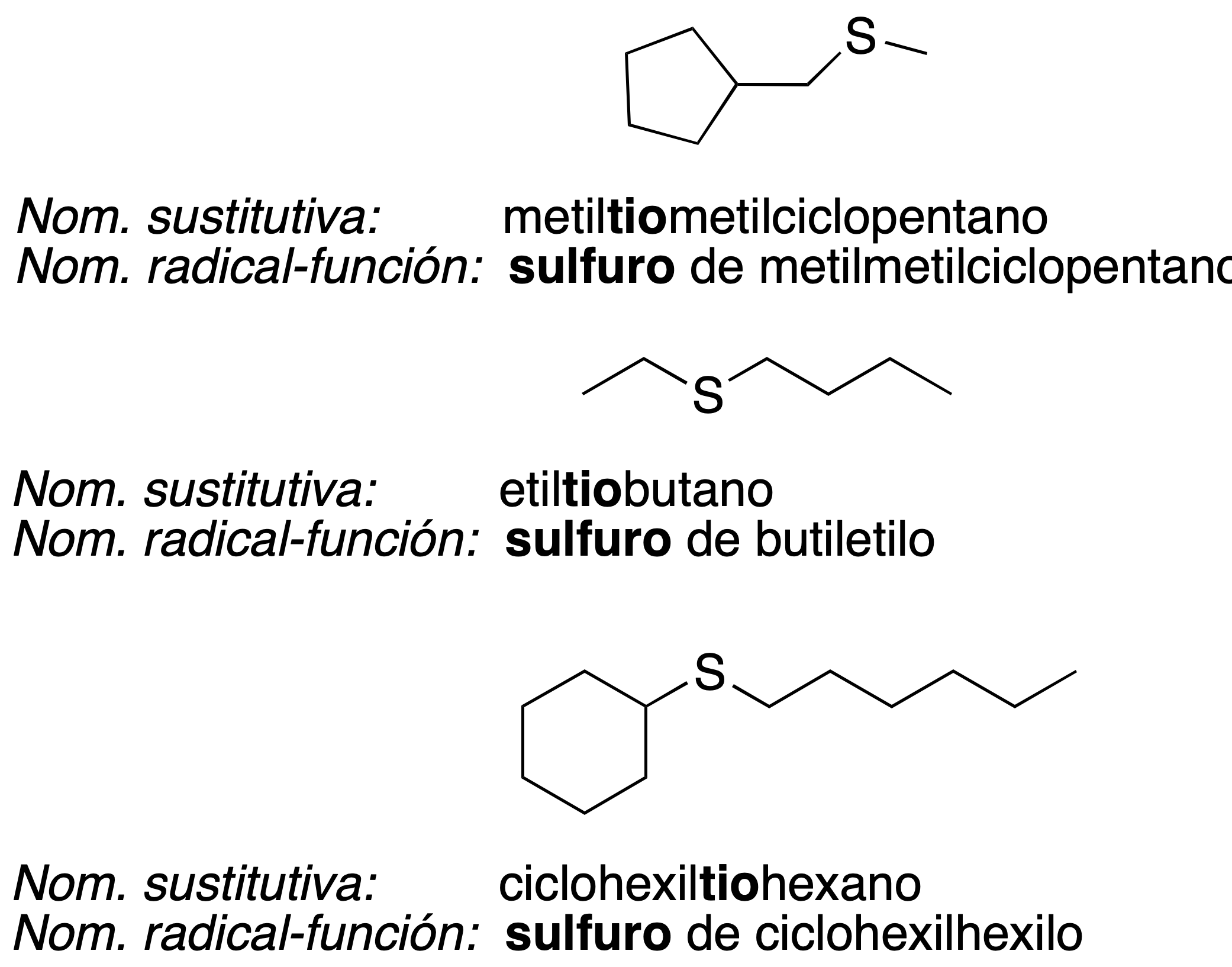
Tiesteres o sulfuros
En química orgánica, un tioéter (o sulfuro) es un compuesto que contiene el grupo funcional formado por un puente de azufre entre dos cadenas carbonadas (R-S-R' o R1-S-R2) como se muestra a la derecha. Siendo el azufre análogo de un grupo éter (R-O-R'), este grupo funcional es llamado grupo tioéter o grupo sulfuro. Como muchos otros compuestos que contienen azufre, los tioéteres volátiles tienen olores característicos desagradables.
Un tioéter es similar a un éter, conteniendo un átomo de azufre en vez de un átomo de oxígeno. Debido a que el oxígeno y el azufre pertenecen al grupo de los anfígenos en la tabla periódica, las propiedades químicas y reactividad de los éteres y tioéteres tienen algunos puntos en común.
EJEMPLOS
¡Ve el siguiente vídeo para conocer más ejemplos!






Excelente actualización
ResponderEliminar