Aminas y compuestos nitrogenados
Derivados nitrogenados de los hidrocarburos
- El nitrógeno tiene la capacidad de formar enlaces sencillos, dobles y triples con los átomos de carbono, lo que determina que sean varios los grupos funcionales nitrogenados posibles.
- Los derivados nitrogenados de los hidrocarburos son: aminas, amidas, nitrilos, y nitrocompuestos.
AMINAS
- Compuestos nitrogenados derivados del amoníaco (NH3 ), donde uno o más grupos alquilos o arilos están unidos al nitrógeno.
- El átomo de N posee un par de elibre, de manera que la forma de la molécula es tetraédrica.
Estructura y enlace
Las aminas son compuestos nitrogenados con estructura piramidal, similar al amoniaco. El nitrógeno forma tres enlaces simples a través de los orbitales con hibridación sp3. El par solitario ocupa el cuarto orbital con hibridación sp3 y es el responsable del comportamiento básico y nucleófilo de las aminas.
- Son compuestos de átomos de nitrógeno unidos a un grupo alquilo o aromático.
- El par de electrones solitario en el nitrógeno los hace básicos y nucleofilicos.
- Muchas aminas son “bioactivas”produciendo diversas respuestas biologicas desde alteración del estado de animo, alucinaciones, o muerte.
Ocurren en plantes y animales
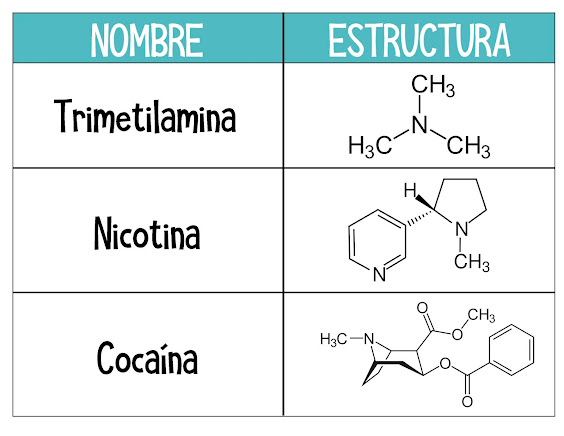
- Trimetilamina – animales; olor de peces.
- Nicotina – tabaco.
- Cocaína – estimulante; arbusto de coca
CLASIFICACIÓN DE LAS AMINAS
- Sustancias muy polares (por la presencia del par de e- aislados).
- Las aminas primarias y secundarias pueden formar enlace puente de H (por el enlace N-H).
- Las aminas terciarias no pueden formar enlace puente de H, pero pueden aceptar puente de H con moléculas que contengan enlaces O-H y N-H.
- Como el N es menos electronegativo que el O, el enlace N-H está menos polarizado que el enlace O-H. Por lo que las aminas forman puentes de hidrógeno más débiles que los alcoholes de pesos moleculares semejantes. Por lo que poseen menor punto de ebullición que los alcoholes análogos.
- Las aminas terciarias, que no pueden formar puentes de hidrógeno, tienen puntos de ebullición más bajos que los de las aminas primarias o secundarias de pesos moleculares semejantes.
- Todas las aminas forman puentes de H con disolventes como el agua y alcoholes. Por eso las aminas de bajo peso molecular son relativamente solubles en ellos.
NOMENCLATURA DE LAS AMINAS
Regla 1. Las aminas se pueden nombrar como derivados de alquilaminas o alcanoaminas. Veamos algunos ejemplos.
Regla 2. Si un radical está repetido varias veces, se indica con los prefijos di-, tri-,...
Si la amina lleva radicales diferentes, se nombran alfabéticamente.
Regla 3. Los sustituyentes unidos directamente al nitrógeno llevan el localizador N. Si en la molécula hay dos grupos amino sustituidos se emplea N,N'.
- Se nombra primeros los grupos alquilos unidos al Nitrógeno seguido de la palabra amina. Se pueden usar los prefijos di o tri para indicar dos o tres grupos sustituyentes iguales.
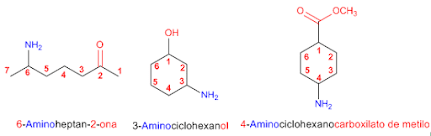
- Las aminas con estructura más complicada se pueden nombrar llamando al grupo -NH2 como amino. El grupo amino se nombra como cualquier otro sustituyente, con un localizador que indique su posición en la cadena o anillo de átomos.
- Otra forma de nomenclatura es elegir la cadena principal que contenga el mayor número de átomos de carbono y se la nombra sustituyendo la terminación -o del alcano por la terminación -amina. La posición del grupo amino y de los sustituyentes o cadenas laterales se indica mediante los correspondientes localizadores. Se emplea el prefijo N- para cada cadena alifática que se encuentre unido al átomo de nitrógeno.
- Las aminas secundarias o terciarias, se nombran tomando el sustituyente más grande como cadena principal, todos los demás grupos se nombran utilizando la letra N- seguida por el nombre del sustituyente.
EJEMPLOS
- Son bases fuertes. Pueden sustraer un protón del agua, formando un ión amonio y un ión hidroxilo. A la constante de equilibrio de esta reacción se le llama constante de basicidad de la amina y se representa por Kb.
- Las alquilaminas son bases más fuertes que el amoniaco. Esta diferencia se explica por el efecto electrón-dador de los grupos alquilo, que estabilizan la carga positiva del nitrógeno, lo que provoca una disminución de la energía potencial del catión correspondiente y desplaza el equilibrio hacia la derecha.
- De acuerdo al anterior razonamiento, se debería esperar que las aminas secundarias fuesen bases más fuertes que las aminas primarias, y las aminas terciarias fuesen bases más fuertes que las aminas secundarias. La situación real es más complicada debido a la solvatación.
AMIDAS
Una amida es un compuesto que se forma conceptual o químicamente por el reemplazo del hidroxilo de un oxácido por un sustituyente amino. En química orgánica, se le denomina por antonomasia como "amida" a las amidas de los ácidos carboxílicos (estrictamente, carboxamida).
- Se sustituye el grupo –OH de un ácido por el grupo amino –NH2 (– NHR o –NRR’ en el caso de amidas sustituidas).
- Una amida importante es la urea, que se encuentra en la orina de los mamíferos.
- Se utiliza como fertilizante y para fabricar plásticos y adhesivos.
Se nombran sustituyendo la terminación -oico o -ico del ácido correspondiente por -amida; o sustituyendo la terminación -o del hidrocarburo del que procede el correspondiente ácido por el sufijo -amida. Si se trata de amidas sustituidas, hay que nombrar además los radicales unidos al nitrógeno, anteponiendo la letra N.
Regla 1. Las amidas se nombran como derivados de ácidos carboxílicos sustituyendo la terminación -oico del ácido por -amida.

Regla 2. Las amidas son grupos prioritarios frente a aminas, alcoholes, cetonas, aldehídos y nitrilos.

Regla 3. Las amidas actúan como sustituyentes cuando en la molécula hay grupos prioritarios, en este caso preceden el nombre de la cadena principal y se nombran como carbamoíl.


- Se caracterizan por tener el grupo funcional -ciano.
- Moléculas reactivas de amplia aplicación en síntesis orgánica. Por ej, la hidrólisis de nitrilos en presencia de ácido fuerte o base fuerte da lugar a ácidos carboxílicos; la hidrogenación catalítica de nitrilos permite la preparación de aminas primarias.
- La cafeína, la nicotina, la morfina, forman una clase muy importante de aminas que se produce en algunos vegetales.
- Los nitroderivados son compuestos cuyas moléculas poseen el grupo funcional nitro (–NO2 ).
- Los derivados aromáticos que poseen varios grupos nitro en la molécula se caracterizan por ser bastante inestables termodinámicamente, por lo que se utilizan como explosivos.
- Este grupo funcional siempre se considera un sustituyente del hidrogeno, por lo que se nombran anteponiendo el prefijo nitro- al nombre del hidrocarburo, indicando con un número su posición en la cadena carbonada.
AMIDAS CÍCLICAS
- Las lactamas son amidas cíclicas obtenidas por condensación, con pérdida de agua, de una molécula que contiene grupo ácido y amino.

El ácido 4-(aminometil)butanoico [1] condensa bajo calefacción para formar N-metilpirrolidin-2-ona [2], un disolvente aprótico polar.
El anillo lactama aparece en numerosos compuestos con actividad biológica, como las penicilinas y cefalosporinas. A continuación, se dibuja la molécula de peniciclina G.

CLASIDICACIÓN DE AMIDAS

EJEMPLOS

¡Ve el siguiente vídeo para conocer más sobre las amidas!












Comentarios
Publicar un comentario